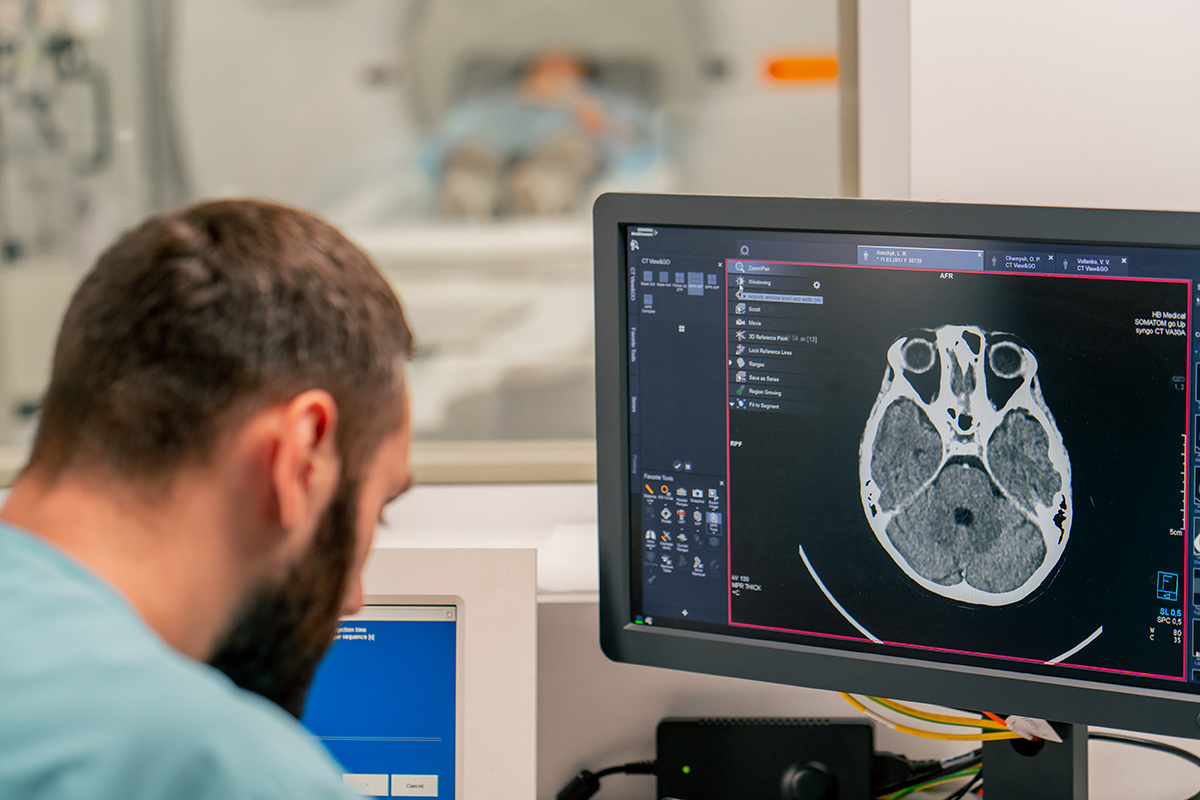
Kunstig intelligens (AI) har et stort potentiale i sundhedsvæsenet og er et vigtigt værktøj til at imødekomme mange af de sundhedsudfordringer, som fremtiden bringer, med stigende levealder, flere patienter med kroniske multisygdomme og mangel på arbejdskraft til at løfte opgaven. Det billeddiagnostiske område er på mange måder frontløber i brugen af AI, da specialet har flest regulatorisk godkendte AI-algoritmer på markedet. Men implementering og klinisk værdiskabelse af disse algoritmer kræver både retænkning af arbejdsgange og organisatoriske ændringer.
Denne kronik er primært baseret på radiologien, da det er det speciale, vi kender bedst. Men mange af pointerne og anbefalingerne kan overføres direkte til implementering af AI i øvrige specialer.
Markant stigning i antallet af undersøgelser
Der er mangel på speciallæger i radiologien og der er store regionale forskelle, hvilket Sundhedsstyrelsens dimensioneringsplan anerkender, og der lægges op til en vækst på op til 86 pct. flere radiologer i 2045 gennem flere uddannelsesstillinger. Fra 696 radiologer i 2021 til 1.293 i 2045 jævnfør Sundhedsstyrelsens lægeprognose 2021-2045.
Desuden er der i takt med store investeringer i nyt diagnostisk udstyr oplevet en markant stigning i antallet af undersøgelser per år (figur 1 og 2), og den teknologiske udvikling har gjort, at hver enkelt undersøgelse i sig selv også er mere datatunggennem flere sekvenser og tyndere snit. En eksponentiel billedmæssig udvikling bevirker, at vi i dag ‘drukner’ i data, som vi ikke kan uddanne os ud af.
Figur 1: Udviklingen i radiologiske modaliteter har medvirket til at forskellige undersøgelser ofte supplerer hinanden fremfor at erstatte, hvilket giver diagnostiske flaskehalse.
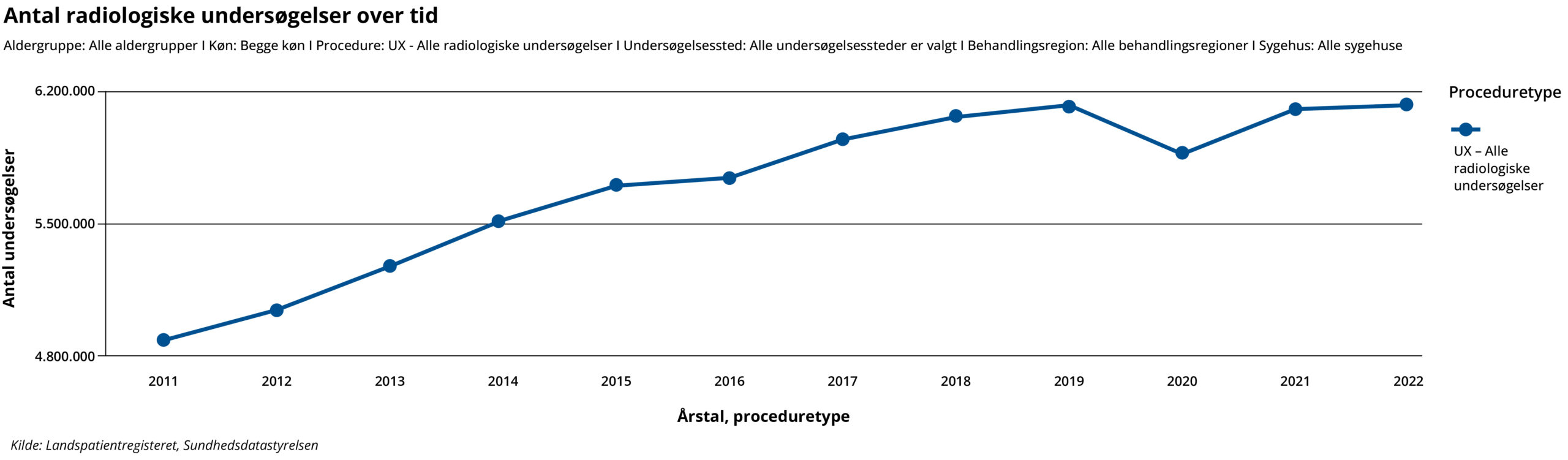
Figur 2: Udviklingen i antallet af radiologiske undersøgelser på landsplan med en samlet stigning fra 4.886.320 undersøgelser til 6.142.245 undersøgelser, svarende til 26 pct. stigning fra 2011 til 2022, baseret på tal fra Landpatientregisteret, Sundhedsdatastyrelsen (esundhed.dk).
Radiologien er derfor blevet en flaskehals med ventetider og kan være et forsinkende led i udredningen og patientbehandlingen, som blev belyst i en artikelserie på DR.dk i oktober 2023 (se her) og som indenrigs- og sundhedsminister Sofie Løhde (V) reagerede på ved at konstatere, at udfordringerne skal løses ved at bruge AI, øge antallet af uddannelsesstillinger og gennem større opgaveglidning (se her).
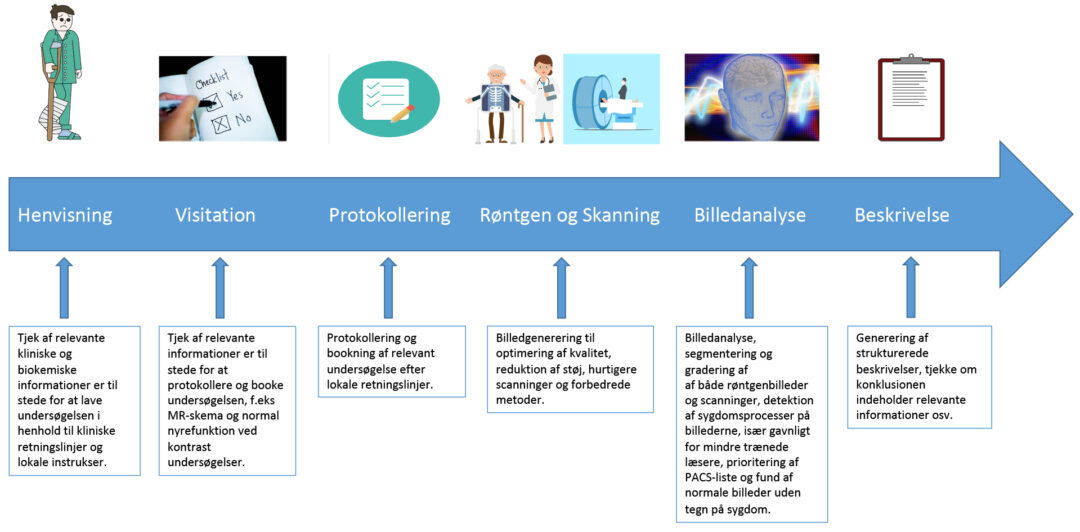
Hvis radiologien skal gøre sig nogle forhåbninger om at kunne følge med i fremtiden, bliver vi nødt til at tænke anderledes. Vi skal rydde op, ‘vælge klogt’, teste hverdagen og befri tiden. Der er undersøgelser, vi skal holde op med at lave, og AI vil være med til at revolutionere det radiologiske speciale og har potentialet til at imødekomme flere af disse udfordringer. Især ved at automatisere nogle rutineopgaver (figur 3). Men der er også en række forudsætninger for, at AI kan udnyttes optimalt, både i radiologien og i sundhedsvæsenet generelt.
Figur 3: AI kan være en medspiller på mange forskellige områder i et patientforløb gennem en radiologisk afdeling.
Potentielt brug af AI-løsninger i patientens rejse i radiologien.
700 godkendte AI-algoritmer
Der findes i dag over 700 regulatorisk godkendte medicinske AI-algoritmer i verden, hvoraf over 80 pct. findes inden for det radiologiske speciale. En afgørende grund til dette er, at radiologien siden slutningen af 1980’erne har haft ét fælles dataformat kaldet DICOM (Digital Imaging and Communications in Medicine), som alle leverandører af radiologisk billeddannende apparatur efterlever i dag. Et fælles dataformat er en absolut forudsætning for at skalere AI-løsninger, og stort set ingen andre kliniske områder er blevet enige om et sådant.
En anden grund til de mange radiologiske algoritmer er, at radiologien har øvet sig i at arbejde digitalt siden starten af 00’erne, og at specialet har store mængder af højteknologisk, digitalt apparatur.
Det er ikke så nemt, som det lyder
Hvorfor er disse algoritmer ikke allerede indkøbt og installeret til gavn for patienter og sundhedsvæsen?
Det er ikke så nemt, som det lyder. Værdiskabelsen er usikker, og selvom en algoritme kan skabe værdi inden for et lille område eller en enkelt afdeling, kan det medføre et øget ressourcetræk andre steder og dermed samlet set være en dårlig investering.
Der mangler viden, erfaring og evidens omkring den kliniske gevinst ved de fleste af disse AI-algoritmer, da der i den regulatoriske godkendelse ikke er krav om dokumentation af dette.
Vores hospitalsorganisationer og patientsammensætning er forskellige, hvilket bevirker, at det er svært at oversætte erfaringer fra et hospital til et andet – endda inden for samme region. Vi vil nødig ende med at installere AI-algoritmer med dertilhørende øget ressourceforbrug for at komme til den samme konklusion som i England, hvor National Institute for Health and Care Excellence (NICE) har måtte stoppe brugen af AI-algoritmer til lungecancer-screening på CT-skanninger og lungecancer-detektion på røntgenbilleder grundet manglende evidens for at disse algoritmer kan løse opgaven uden potentiel patientskade (læs her).
Det er også vigtigt at forstå, at de fleste af disse algoritmer er godkendt som såkaldt ‘beslutningsstøtte’ (Medical Device Regulativ, MDR, klasse 2A) og ikke som ‘beslutningstager’ (MDR klasse 2B). Det betyder, at algoritmen ikke må arbejde selvstændigt, og at ansvaret fortsat ligger hos sundhedspersonalet, der anvender algoritmen.
Radiologer der bruger AI-algoritmer kan derfor opleve, at det er mere tidskrævende at bruge AI-algoritmer, da man både selv skal tolke billederne, men også skal forholde sig til resultatet af algoritmen, og dermed lægges der potentielt yderligere pres på at kunne komme i mål med det stigende antal manglende beskrivelser. Den potentielle kliniske gevinst fra denne første bølge af AI-algoritmer ligger muligvis mere i en anden afdeling som f.eks. akutmodtagelsen, hos patienten eller for hospitalet, og ikke nødvendigvis i radiologien.
Da CE-mærket ikke specificerer den lokale kliniske gevinst, er det således op til hver afdeling at bruge og afdække værdien, som igen afhænger af patientgrundlaget, organiseringen og hvor i beslutningsprocessen, AI-algoritmen implementeres. Sagt med andre ord: Da AI-algoritmerne altid løser den samme opgave ens på de samme data, er det ikke sikkert, at den giver samme værdi i en organisation, medmindre de forskellige afdelinger har det samme patientmix og workflow. Dette udfordrer spørgsmålet omkring skalering, ansvar og finansiering af AI-algoritmerne, som i dag er uafklaret.
AI-algoritmer skaber flere falsk positive fund end lægen
Flere AI-algoritmer er blevet testet i danske forskningsprojekter og er i enkelte tilfælde i drift. Flere af algoritmerne performer anderledes og ofte dårligere end deres godkendelse lover, når de bliver eksternt valideret på lokale real life patientdata. Det viser sig især ved at AI-algoritmerne mange gange har en lidt lavere specificitet, hvilket betyder, at de genererer flere falsk positive fund end speciallægen. Dette kan være med til at belaste systemet unødigt, da falsk positive fund ofte udløser supplerende undersøgelser og dermed et øget ressourceforbrug samt uhensigtsmæssige patientforløb.
Det betyder ikke, at algoritmerne er dårlige. De performer blot som de er trænet og godkendt til, men de afspejler ikke nødvendigvis den egentlige patientpopulation, som man vil bruge dem i. Andre gange kan man dog opleve det modsatte, men det ved man ikke, medmindre det testes på lokale data.
CE-mærkede algoritmer er godkendte til at performe på de data, det patientmix og den sygdomsprævalens, som de er trænet og valideret på, og vil derfor performe anderledes, når de bliver anvendt på andre scannere, røntgenapparater, softwareversioner og patientpopulationer med andre sygdomsprævalenser. Er en fraktur-algoritme f.eks. ikke trænet på skråbilleder, kan den fejlagtigt overfortolke projektionen som en luksation. Er en thorax-algoritme udviklet på en asiatisk population, er der risiko fo,r at infiltrater tolkes som tuberkulose i større omfang, end tuberkulose findes i den danske population.
Her er forudsætninger for at bruge AI i radiologien
Gennem de sidste fire år er der opnået erfaringer med at udvikle, implementere og bruge AI i radiologien, herunder undersøge hvilke forudsætninger, der skal være til stede. Det er sket gennem forskning, test og implementering af AI-løsninger i bl.a. mammografiscreeningen, Radiologisk AI-testcenter (RAIT.dk) i Region Hovedstaden, Center for Clinical AI (CAI-X) i Region Syd og lignende initiativer i andre regioner.
I 2023 nedsatte Danske Regioner et AI-spor på tværs af regionerne og brugte radiologien som usecase til udarbejdelse af anbefalinger og dele erfaringer om brug af AI i sundhedsvæsenet med deltagelse af radiologiske ledere samt flere AI-forskere fra alle fem regioner. På tværs af regionerne var der enighed om, at forudsætningen for at implementere og skalere brugen af AI i radiologi er, at der etableres en ensartet ramme for:
- En IT-infrastruktur til at teste AI-performance på lokale data inden indkøb af en algoritme.
- Etablering af et system der kan monitorere og kvalitetssikre AI-performance over tid under eventuel klinisk drift, når data ændrer sig.
- Flere prospektive implementeringsstudier for at afdække den kliniske værdi.
- Sikring af uddannelse, kompetenceløft og ansvar ved brug af AI-løsninger.
- Et ensartet governance-system, der som minimum bør omfatte klare retningslinjer for indkøb, brug, vedligeholdelse af faglige kvalifikationer, patientinformation, produktopdatering og vedligeholdelse af algoritmerne og etablering af mekanismer til at håndtere uforudsete situationer, såsom fejl, bias i algoritmer eller ændringer i sundhedsdata.
Disse konklusioner flugter alle med konklusionen i et white paper fra AI-eksperter fra de fleste radiologiske selskaber i verden om absolutte forudsætninger og infrastruktur behov ved brug af AI i radiologien, publiceret i januar 2024 (læs her).
Norsk minister for AI
Der er behov for en robust IT-infrastruktur som muliggør hurtigere behandling og analyse af store datasæt. Når dette er etableret, er det meget nemmere at skalere AI og flytte forskellige AI-løsninger mellem regioner og teste hvilken diagnostisk værdi, de har på lokale data via f.eks. federated learning, hvor man flytter AI-modellen, der skal testes, mellem sikre, ensartede datamiljøer i hver region i stedet for at flytte data til anden lokation uden for hospitalernes firewall.
Kun ved at bygge dette fundament sikres det, at AI udnyttes optimalt og bidrager til at forbedre patientbehandlingen og frigøre ressourcer, der kan anvendes mere optimalt.
Det er sikkert, at AI er kommet for at blive, både i radiologien og i andre specialer. Det kræver politisk, organisatorisk og ledelsesmæssig prioritering samt økonomi for at udvikle, udnytte potentialet og høste gevinsten af AI i sundhedsvæsenet. Derfor er det vigtigt, at afdelingsledelser, hospitalsledelser, regionsdirektioner og politikere i Danmark prioriterer at fremme implementeringen af AI – og tilegner sig viden om emnet.
I England er der sat over 200 mio. kr. af til at generere lokale erfaringer med AI i radiologi på omkring 160 forskellige hospitaler. I Norge er der sat en mia. kr. af til AI-området, etableret et nationalt AI-institut (NORA), publiceret specifikke guidelines til sikker implementering og anvendelse af AI i sundhedsvæsenet og udnævnt en minister, der kun fokuserer på dette område.
Her er anbefalingerne
Det anbefales at:
- Investere i mere forskning og udvikling samt prospektiv implementering af AI-løsninger i radiologien, da klinisk værdi ikke er givet ud fra den regulatoriske godkendelse. AI kommer med en pris, og det er ikke kun valideringen, der koster ressourcer, det gør implementeringen og den daglige drift også.
- Udarbejde en model for governance og investere i sikre IT-systemer efter samme template i alle regioner til sikker indsamling og opbevaring af lokale billeddata. Disse data skal anvendes til test og validering forud for klinisk brug samt til løbende kvalitetssikring af AI-algoritmer efter eventuel klinisk ibrugtagning.
- Opbygge kompetencer inden for radiologisk AI ved at uddanne radiologisk personale og kliniske brugere i både anvendelsen og forståelsen af AI.
- Ansætte flere AI-specialister samt implementeringsspecialister, også fra andre faggrupper, til at afdække de kliniske og økonomiske gevinster samt potentielle tab.
- Udarbejde retningslinjer og indsamle implementeringserfaringer med brugen af radiologisk AI. Disse retningslinjer skal også omfatte etiske overvejelser og patientsikkerhed.
- Udarbejde instrukser og informationsmaterialer i samarbejde med patienter, praktiserende læger og øvrige relevante myndigheder.
Vi skal bruge AI som en nedrivningskugle og komme i gang med at øve os, men kun ved at samarbejde, tænke innovativt, strategisk, tværfagligt og tværsektorielt samt afsætte den nødvendige økonomi og arbejdskraft, så vi kan lykkedes med at implementere AI i radiologien og i resten af sundhedsvæsenet.